Diagnose

Seitenübersicht:
Zusammenfassung:
Das Schwierigste an der Diagnose ist es wohl, überhaupt erst einmal einen Ausgangsverdacht auf eine Mastzellaktivierungserkrankung (MCAD) zu entwickeln und diese Verdachtsdiagnose in die differentialdiagnostischen Überlegungen mit einzubeziehen.
Arztwahl
Die für die Diagnose der MCAD notwendigen Abklärungen können von jeder Hausarztpraxis vorgenommen oder veranlasst werden. Auch wegen der Überlastung der Spezialärzte wäre es sinnvoll, wenn so weit wie möglich die Hausärzte die Federführung übernehmen würden. Bei speziellen Fragestellungen oder in schwierigen Fällen kann mit dem nächstgelegenen Kompetenzzentrum für Mastzellerkrankungen Kontakt aufgenommen oder der Patient dort hin überwiesen werden.
Adressen von MCAD-Kompetenzzentren in Europa
Mastzellen entstehen im Knochenmark und werden zu den Blutzellen gezählt (obwohl sie nicht im Blut vorkommen). Auf Erkrankungen des Blutes sowie der blutbildenden Organe (Knochenmark) sind die Hämatologen spezialisiert. Auch viele Allergologen kennen sich mit MCAD aus. Allergologen sind aber vor allem bezüglich Differenzialdiagnostik (Abklärung anderer Unverträglichkeiten, Allergiescreening) meist sehr kompetente Ansprechpartner und könnten daher auch für eine Erstbeurteilung aufgesucht werden.
Diagnosekriterien für MCAD
Diagnostische Definition von Mastzellaktivierung (MCA)
Sind diese drei Kriterien miteinander erfüllt, kann man davon ausgehen, dass man es mit einer Mastzellaktivierung (MCA) zu tun hat [Valent et al. 2012, S. 215; Brockow 2013; Molderings et al. 2014]:
- Typische Symptome vorhanden, nicht anders erklärbar und therapiebedürftig.
- Erhöhte Mediatorkonzentrationen oder deren Abbauprodukte nachweisbar
- Ansprechen auf die Therapie mit mastzellspezifischen Medikamenten
Schwierigkeiten:
Kriterium 1: Die Symptome alleine sind unspezifisch und daher nicht beweisend.
Kriterium 2: Der Nachweis von Mastzellmediatoren oder deren Abbauprodukte gelingt sehr oft nicht, aus den weiter unten dargelegten Gründen. Daher muss das Kriterium 2 in der Praxis wohl meist fallen gelassen werden und ist kein Ausschlusskriterium.
Kriterium 3: Das Ansprechen auf Medikamente kann behindert sein wegen Durchfall (dann kann intravenöse Verabreichung versucht werden), weil nur die gesunden, sekundär aktivierten Mastzellen, nicht aber die krankhaft veränderten beeinflussbar sind, oder weil ungeeignete Präparate mit unverträglichen Wirkstoffen oder unverträglichen Hilfsstoffen gewählt wurden, seltener auch wegen Allergie auf einen Inhaltsstoff.
Anschliessend muss differenzialdiagnostisch geklärt werden, ob die Mastzellaktivierung durch eine MCAD verursacht wird, oder sekundären Ursprungs sein könnte (z. B. Allergien, entzündliche Erkrankungen).
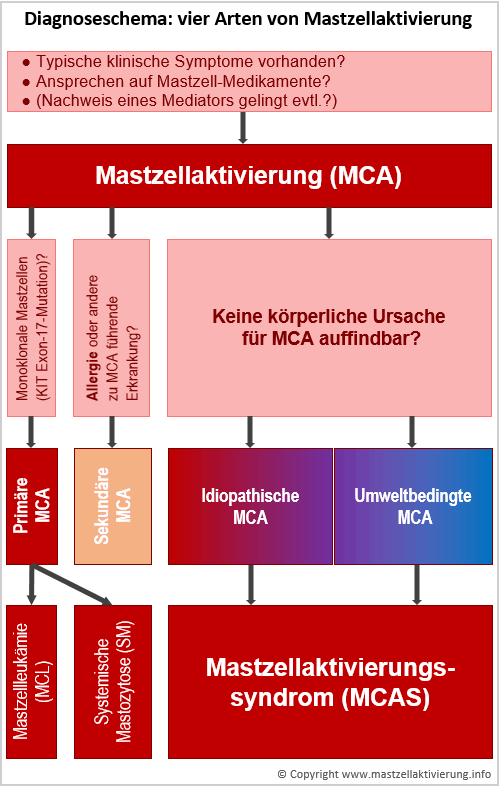
Es kann unterschieden werden zwischen primärer, sekundärer, idiopathischer und umweltbedingter Mastzellaktivierung:
- Primär: Formen von Mastozytose mit bekannter körperlicher Ursache.
- Sekundär: andere Erkrankungen mit Mastzellaktivierung, z.B. Allergien
- Idiopathisch: unbekannte Ursache. Vermutlich ebenfalls zur Mastozytose zu zählen, obwohl die derzeit geltenden WHO-Diagnosekriterien nicht erfüllt werden.
- Umweltbedingt: Aktivierung auf Grund ungünstiger äusserer, nicht körperlicher Ursachen. Auch die Mastzellen jedes gesunden Menschen lassen sich bei ausreichender Reizstärke aktivieren.
Diagnosekriterien für MCAS und Mastozytose
Vorgeschlagene Diagnosekriterien für das Mastzellaktivierungssyndrom (MCAS) und die offiziellen WHO-Kriterien zur Diagnose von systemischer Mastozytose (SM), in Anlehnung an Molderings et. al. [2011, Tab. 2]:
| Kriterien für das Mastzellaktivierungssyndrom (MCAS) | WHO-Kriterien für systemische Mastozytose (SM) |
|---|---|
| Die Diagnose MCAS wird gestellt, wenn beide Hauptkriterien oder das zweite Hauptkriterium und mindestens ein Nebenkriterium erfüllt sind. | Die Diagnose SM wird gestellt, wenn das Hauptkriterium und mindestens ein Nebenkriterium oder mindestens drei Nebenkriterien erfüllt sind. |
| Hauptkriterien | Hauptkriterium |
| Dichte Infiltrate von Mastzellen, verstreut oder in Nestern, in Biopsien aus Knochenmark oder anderen inneren Organen/Geweben (nicht aus der Haut), angefärbt mit CD117, Tryptase und CD25. | Mehrere dichte Mastzellinfiltrate (> 15 Mastzellen pro Ansammlung) in Biopsien aus Knochenmark oder anderen inneren Organen/Geweben (nicht aus der Haut), angefärbt mit CD117, Tryptase und CD25. |
| Vorhandene Symptomatik lässt eine erhöhte Mastzellaktivität vermuten (Mastzellmediatorsyndrom) | |
| Nebenkriterien | Nebenkriterien |
| Mehr als 25% der Mastzellen in der Biopsie (Ausstrich oder Histologie) haben eine atypische Form (spindelförmig oder oval anstatt rund). | Mehr als 25% der Mastzellen in der Biopsie (Ausstrich oder Histologie) haben eine atypische Form (spindelförmig oder oval anstatt rund). |
| Mastzellen im Knochenmark exprimieren CD2 und/oder CD25 | Mastzellen im Knochenmark exprimieren CD2 und/oder CD25 |
| Nachweis von genetischen Veränderungen in Mastzellen aus Blut, Knochenmark oder inneren Organen, die bekanntermassen die Mastzellaktivität erhöhen | KIT D816V-Mutation in Mastzellen aus inneren Organen/Geweben |
| Nachweis einer krankhaft erhöhten Freisetzung eines Mastzellmediators (relativ zum Grundspiegel in der symptomarmen Phase) bei Bestimmung von Tryptase im Blut, N-Methylhistamin im Urin, Heparin im Blut, Chromogranin A im Blut, oder von anderen mastzellspezifischen Mediatoren (z.B. Leukotriene, Prostaglandin D2) | Totale Serumtryptase >20 ng/ml (nicht zutreffend bei gleichzeitiger Nichtmastzell-Bluterkrankung) |
Keine Ausschlusskriterien
Die WHO-Kriterien sind keine absoluten Diagnosekriterien, sondern ein vorläufiges Klassifikationssystem mit bestimmten Einschlusskriterien. Sie sind jedoch nicht ausreichend sensitiv und spezifisch. Werden die Kriterien nicht erfüllt, darf dies nicht dazu verleiten, eine MCAD auszuschliessen. [Homann et al. 2010b]
Vorgehen bei der Diagnose
Grob skizziert könnte das Vorgehen wie folgt aussehen:
1. Anamnese (Arzt-Patienten-Gespräch)
Schwierigkeiten, derer sich der Arzt bewusst sein sollte:

- Das Beschwerdebild ist uneinheitlich, präsentiert sich von Fall zu Fall wieder ganz anders, ist wandelbar wie ein Chamäleon.
- Die Erfahrungsberichte sind meist unvollständig. Der Arzt sieht nur die Spitze des Eisbergs.
- Die Auslöser sind schwer identifizierbar. Unverträgliches wird oft irrtümlich für verträglich gehalten.
- Symptombekämpfungsdenken anstatt Systemverständnis. Es werden bloss Medikamente gegen einzelne Symptome abgegeben, anstatt die Ursache zu verstehen und möglichst gezielt anzugehen.
- Viele Diagnosen, aber ausbleibende Therapieerfolge sind typisch. Oft werden einzelne Mastzellmediator-Symptome oder Folgeerkrankungen für die eigentliche Krankheit gehalten, ohne die zu Grunde liegende Mastzellerkrankung zu sehen (z.B. "Reizdarmsyndrom", "nichtallergische Rhinitis", "Urtikaria", "chronisches Erschöpfungssyndrom", "Einschlaf- und Durchschlafstörungen", "Psychosomatik"). Eine Flut von Diagnosen und Therapieversagen in der Vergangenheit sollten deshalb den Arzt an eine MCAD denken lassen.
- Entgegen der bisherigen Lehrmeinung sind MCAD gar nicht selten, sondern betreffen einen zweistelligen Prozentsatz der Bevölkerung! Betroffene suchen zudem wohl überdurchschnittlich oft einen Arzt auf. Mit hoher Wahrscheinlichkeit ist deshalb eine MCAD die eigentliche, wenn auch nicht offensichtliche, Ursache für Arztkonsultationen.
- Die Mastozytose ist keine reine Hauterkrankung. Es können auch alle anderen Organsysteme in unterschiedlicher Konstellation betroffen sein, mit oder ohne Hautbeteiligung, so dass dem Patienten äusserlich nichts anzusehen ist.
2. Differentialdiagnostik
Die Differentialdiagnostik (Abklärung anderer Erkrankungen, die ebenfalls für die beobachtete Symptomatik verantwortlich sein könnten) ist ein kompliziertes Detektivspiel, das wir hier nicht umfassend darstellen können. Das Vorgehen ist sehr vom individuellen Einzelfall abhängig und gehört in die Hände einer Fachperson. Wenn die Symptome von mehreren körperlichen Ursachen ausgelöst werden, bringt es nur wenig, wenn man bloss eine dieser Erkrankungen therapiert. Auch an die Möglichkeit einer mittels Prick- oder Bluttest nicht feststellbaren seronegativen gastrointestinalen Allergie sollte gedacht werden.
3. Labordiagnostik
Die Diagnosestellung der MCAD wird zumindest in absehbarer Zukunft in erster Linie darauf basieren, erhöhte Konzentrationen mastzellspezifischer Mediatoren oder deren Abbauprodukte (Metaboliten) in Blut und Urin laborchemisch nachzuweisen. Diese wie auch die anderen hier beschriebenen Methoden haben jedoch ihre Schwächen.
Mediatornachweis
Der Nachweis eines der vielen freigesetzten Mastzellmediatoren oder deren Abbauprodukte misslingt sehr oft oder sogar meistens. Dies weil sie an Rezeptoren binden oder abgebaut werden, bevor sie in die Blutbahn gelangen, oder aus vielen anderen Gründen. Daraus ergeben sich zwei Schlussfolgerungen:
- Nur ein positiver Befund kann aussagekräftig sein. Ein negativer Befund kann das Vorliegen einer MCAD nicht ausschliessen.
- Die nachgewiesenen Konzentrationen lassen keine Rückschlüsse auf den Schweregrad der Erkrankung bzw. auf die Intensität der Symptome zu [Broesby-Olsen S et al. 2013].
Zur Diagnosesicherung und Subklassifizierung einer MCAD wird die Bestimmung von Tryptase und Heparin im Blut sowie Methylhistamin im Sammelurin empfohlen. In Zukunft seien auch weitere Biomarker mit einzubeziehen, sobald diese in der kommerziellen Routinediagnostik bestimmbar werden sollten. [Molderings 2014]
Magenspiegelung, Darmspiegelung, Gewebeproben
Da fast immer auch der Verdauungstrakt von Problemen betroffen ist, wird für eine genauere Abklärung eine Magenspiegelung (Gastroskopie) und eine Darmspiegelung (Koloskopie) empfohlen. Diese Untersuchungen dienen auch der Entnahme von Gewebeproben (Biopsien), die auf auffällige Anordnungen und Formen (Morphologie) der Mastzellen und erhöhte Mastzelldichte untersucht werden. Nur positive Biopsiebefunde sind aussagekräftig. Negative Befunde dürfen nicht als Ausschlusskriterium gesehen werden.
Mutationsanalyse
Da MCAD oft durch genetische Mutationen in Mastzellen hervorgerufen werden, liegt es nahe, mittels Gentests oder Mutationsanalysen nach abweichenden Genvarianten zu suchen. Meist handelt es sich aber um noch unvollständig bekannte Kombinationen mehrerer erworbener Gendefekte, die mehrere Gene betreffen. Da in der Gewebeprobe nur wenige Einzelzellen mutiert sind, sind solche Mutationsanalysen methodisch aufwändiger als ein normaler Gentest. Derzeit ist einzig die spezifische PCR-Untersuchung auf das Vorliegen der KITD816V-Mutation routinemässig verfügbar.
Knochenmarkbiopsie
Die Untersuchung einer Gewebeprobe aus dem Beckenknochenmark kann als zusätzliches Diagnosekriterium dienen, auf eine eventuell bestehende hämatologische Zusatzerkrankung (Erkrankung von Blutzellen) oder auf übermässige Einwanderung von Mastzellen aufmerksam machen. Angewendet wird sie höchstens, wenn die anderen Diagnosekriterien einen Verdacht auf systemische Mastozytose liefern (Tryptasespiegel basal > 20 ng/ml; morphologisch auffällige Mastzellen in den Biopsien aus dem Gastrointestinaltrakt). Falsch negative Resultate sind häufig, da oft kein Nest mit mutierten Mastzellen getroffen wird. Nur ein positiver Befund ist aussagekräftig.
Versuchsweise Durchführung der Therapie
Die oben aufgeführten Diagnosemethoden liefern nur in einem kleinen Teil der Fälle ein positives Testergebnis. Die meisten MCAD-Betroffenen würden durch die Maschen fallen und keine Diagnose erhalten (falsch negatives Resultat). Nicht nur die positiv getesteten, sondern speziell auch die negativ getesteten, sollen deshalb einen weiteren Diagnoseschritt durchlaufen: Das versuchsweise (probatorische) Durchführen einer auf Mastzellen ausgerichteten Therapie (Auslöser meiden, Medikation) während einer begrenzten Zeitdauer. Details siehe Seite Therapie und Unterseiten. Für Ärzte mag es vielleicht ungewohnt und gewöhnungsbedürftig sein, eine Therapie zu beginnen, bevor eine hieb- und stichfeste Diagnose vorliegt. Mangels besserer Alternativen ist dies jedoch bei einem vermuteten Mastzellmediatorsyndrom das Sinnvollste und Zielführendste, was man machen kann.
Bei Nichtansprechen auf die Medikation verabreicht man, wenn dies durchfallbedingt sein könnte, die Wirkstoffe anfangs intravenös.
Arztwahl
Auch heute noch ist es sehr schwierig, einen mit der Abklärung von Mastzellmediatorsyndromen bzw. Histaminose vertrauten und kompetenten Arzt zu finden. Uns fehlen die Informationen, um beurteilen zu können, wer auf einer Empfehlungsliste aufgeführt werden soll und wer nicht. Ungerechtigkeiten wären vorprogrammiert. Auch könnten wir eine Liste empfehlenswerter Ärzte nicht permanent dem wechselnden Erfahrungs- und Wissensstand der Ärzte anpassen; sie wäre bald nicht mehr aktuell. Die Diagnose von Mastzellerkrankungen ist für alle Ärzte ein anspruchsvolles Detektivspiel, das nicht nur vom Geschick des Arztes, sondern auch von der Komplexität des Einzelfalls abhängt. Noch fehlt ein aussagekräftiges Vorgehen, um eine Mastzellerkrankung in jedem Fall zweifelsfrei feststellen zu können. Oft muss man es bei einer Verdachtsdiagnose belassen. Wer mit der Erwartung zum Arzt geht, eine Diagnose, eine ausführliche Instruktion und eine intensiv betreute Behandlung zu erhalten, wird leider meist enttäuscht. Aus diesen Gründen haben wir bisher trotz riesiger Nachfrage noch keine eigene Liste mit Adressen von spezialisierten Ärzten erstellt. Hier dennoch ein paar Hilfestellungen für die Suche nach einer geeigneten Fachperson:
Hausarzt, Allgemeinmediziner
Da ein ein- bis zweistelliger Prozentsatz der Bevölkerung betroffen ist, und es aber nur wenige Spezialärzte für Mastzellerkrankungen gibt, kann man sich leicht ausrechnen, dass wenn möglich die Hausärzte / Allgemeinmediziner die Federführung bei der Betreuung dieser Fälle übernehmen sollten. Um die Fachärzte zu entlasten, sollten diese nur bei speziellen Fragestellungen (z.B. Labordiagnostik) oder in schweren oder komplizierten Fällen konsultiert werden. Die grosse Mehrzahl der Allgemeinpraktiker scheint bisher leider noch überhaupt nicht mit dem Thema vertraut, geschweige denn auf dem aktuellen Stand zu sein. Versuchen Sie dennoch als erstes, einen Hausarzt in der Nähe Ihres Wohn- oder Arbeitsortes zu finden, der entweder bereits Erfahrungen auf diesem Gebiet gemacht hat oder bereit ist, zu lernen und sich unter Anleitung auf etwas für ihn Neues einzulassen. Diese Website bietet nicht nur einen ersten Einstieg in die anspruchsvolle Thematik, sondern auch viele ergänzende Informationen, Hilfsmittel, Literaturangaben und weiter führende Links.
Spezialarzt, Fachspezialist
Falls Ihr Hausarzt unseren Informationen nicht traut (Ärzte zeigen oft grosse Skepsis gegenüber allem, was im Internet steht), und auch mit der Fachliteratur überfordert ist (empfohlene Lektüre siehe hier), hat er die Möglichkeit, mit einem Kompetenzzentrum für Mastzellerkrankungen in Ihrer Region Kontakt aufzunehmen, um sich abzusichern, welches Vorgehen allgemein oder im Einzelfall Sinn macht. Für bestimmte Abklärungen, die der Hausarzt nicht selbst vornehmen kann, kann er den Patienten an ein solches Kompetenzzentrum überweisen.
Adressen Kompetenzzentren für Mastzellerkrankungen
Das European Competence Network on Mastocytosis ECNM nennt die Adressen von Ärzten und Kliniken in Europa, die auf Mastzellerkrankungen spezialisiert sind und als Kompetenzzentren (Centers of Excellence) gelten. Wenn eine Mastzellerkrankung die Ursache für die Histaminose ist, findet man dort kompetente Hilfe.
Falls Sie keinen Hausarzt finden können, der Sie in Bezug auf eine vermutete Mastzellerkrankung oder Histaminose untersuchen möchte, bitten Sie ihn, dass er Sie an eines der oben erwähnten Kompetenzzentren überweist. In den meisten Kompetenzzentren oder Unikliniken ist es nicht möglich, dass Patienten sich auf eigene Faust anmelden, sondern es braucht zwingend eine ärztliche Überweisung. In einigen Kliniken kommt es vor, dass man wegen Überlastung mehrere Monate auf einen Termin warten muss.
Zuständigkeit, Fachgebiet: Bei Verdacht auf eine Mastzellerkrankung werden umfangreichere detaillierte Abklärungen vom Hämatologen vorgenommen. Der Hämatologe befasst sich mit den Erkrankungen des Blutes sowie der blutbildenden Organe (Knochenmark). Mastzellen zählt man abstammungsmässig zu den Blutzellen (obwohl sie nicht im Blut vorkommen) und sie entstehen im Knochenmark.
Es gibt auch viele Allergologen, die sich hierin auskennen, besonders in einzelnen Universitätsspitälern und Privatkliniken, aber es gibt auch solche, die das Thema noch beharrlich ignorieren oder nicht auf dem neusten Stand sind. Allergologen sind jedoch bezüglich Differenzialdiagnostik (Abklärung anderer Unverträglichkeiten, Allergiescreening) meist sehr kompetente Ansprechpartner. Allergien haben grosse Ähnlichkeit mit Mastzellerkrankungen (bei Allergien spricht man von sekundärer Mastzellaktivierung) und allergische Erkrankungen wie auch Autoimmunerkrankungen treten sehr häufig als Begleiterkrankung von Mastzellerkrankungen auf. Deshalb macht es sogar Sinn, erst nach einer Erstbeurteilung durch den Allergologen den Hämatologen aufzusuchen.
Ernährungsberatung
Ihr Hausarzt oder Spezialarzt kann Sie an eine(n) Ernährungsberater(in) überweisen. Eine Ernährungsberatung kann Sie bei der versuchsweisen Durchführung einer Auslassdiät (=Eliminationsdiät) instruieren und unterstützen, sowie das Ernährungs- und Symptomtagebuch analysieren und auswerten. Anschliessend kann evtl. auch der Kostaufbau während der therapeutischen Eliminationsdiät begleitet werden, um eine ausgewogene Ernährung sicherzustellen.
Die Ernährungsberatung wird von der Krankenkasse bezahlt, falls die Überweisung durch einen Arzt erfolgte (bezieht sich auf die Schweiz, wird aber möglicherweise in anderen Ländern ähnlich gehandhabt). Auf eigene Initiative eine Ernährungsberaterin aufzusuchen, ist ebenfalls möglich, muss dann aber selbst bezahlt werden. (Z.B. wenn man in einem leichten, unkomplizierten Fall die Ernährungsumstellung ohne Arzt ausprobieren, sich aber dennoch bzgl. ausgewogener Ernährung beraten lassen möchte).
Bevorzugen Sie diplomierte Ernährungsberater(innen) HF/FH, die einen Fortbildungskurs zum Thema Nahrungsmittelallergien und -intoleranzen absolviert haben, oder sich anderweitig auf Nahrungsmittelunverträglichkeiten spezialisiert haben.
Diagnosekriterien für Systemische Mastzellaktivierungserkrankungen (MCAD)
Diagnostische Definition von Mastzellaktivierung (MCA)
Als erstes ist zu klären, ob wir es überhaupt mit Mastzellaktivierung (MCA) zu tun haben. Es gibt andere Krankheiten, die einer MCA gleichen (ähnliche Symptomatik wie beim Mastzellmediatorsyndrom), ohne dass aber die Mastzellen involviert wären. Wenn die folgenden drei Kriterien miteinander erfüllt sind, kann man davon ausgehen, dass man es mit einer Mastzellaktivierung (MCA) zu tun hat [Valent et al. 2012, S. 215; Brockow 2013; Molderings et al. 2014]:
- Zwei oder mehr typische klinische Symptome sind dauerhaft oder episodisch wiederkehrend vorhanden. Sie können nicht durch andere bekannte Erkrankungen oder Zustände erklärt werden. Mindestens eines davon erfordert eine therapeutische Intervention.
- Während oder kurz nach dem Auftreten von Symptomen ist ein deutlicher vorübergehender Anstieg (relativ zur Baseline) von Gesamt-Tryptase im Serum, oder von anderen Mastzellmediatoren (Heparin [Vysniauskaite et al. 2015], Histamin, Prostaglandin D2) oder von deren Abbauprodukten im Urin nachweisbar.
- Ansprechen auf die Therapie mit Medikamenten, welche die Aktivierung von Mastzellen bzw. die Freisetzung oder Wirkung von Mastzellmediatoren hemmen (z.B. Mastzellstabilisatoren, Antihistaminika, Anti-Leukotriene) [Brockow and Ring 2011, S.295]
Schwierigkeiten:
Kriterium 1: Die Symptome sind für sich alleine betrachtet unspezifisch und daher noch kein Beweis für das Vorliegen von MCA.
Kriterium 2: Der Nachweis von Mastzellmediatoren oder deren Abbauprodukte gelingt sehr oft nicht. Diese Botenstoffe werden grösstenteils an Rezeptoren gebunden und noch im Gewebe wieder abgebaut, so dass sie gar nicht bis in die Blutbahn oder in das Lymphsystem gelangen. Daher muss das Kriterium 2 in der Praxis wohl meist fallen gelassen werden. Es kann keinesfalls als Ausschlusskriterium gewertet werden. Gelingt der Nachweis nicht, kann trotzdem Mastzellaktivierung vorliegen.
Kriterium 3: Ein Grossteil der Betroffenen leidet unter Durchfall, wodurch die Wirkstoffaufnahme in den Körper nur begrenzt funktioniert. Hinzu kommt, dass nur die gesunden Mastzellen, welche von den mutierten Mastzellen sekundär aktiviert wurden, auf die Medikamente ansprechen, während die mutierten Mastzellen daueraktiviert bleiben. Beides kann dazu führen, dass das Ansprechen auf Medikamente nicht wie erwartet beobachtet werden kann. Dann kann man eine intravenöse Verabreichung in Erwägung ziehen, um die Wirkstoffe am Verdauungstrakt vorbei in den Körper zu bringen. Bei der Wahl der Präparate ist zudem darauf zu achten, dass weder unverträgliche Wirkstoffe noch unverträgliche Hilfsstoffe enthalten sind. Diese sind jedoch noch nicht abschliessend bekannt. Seltener könnten auch echte Allergien gegen einzelne Inhaltsstoffe vorliegen.
Wenn man zum Schluss kommt, dass es sich um Mastzellaktivierung handeln könnte, gilt es als nächstes, die Diagnose weiter zu verfeinern: Ob dieses Mastzellmediatorsyndrom wirklich durch eine MCAD verursacht wird, oder ob die gesteigerte Mastzellaktivität sekundären Ursprungs sein könnte (z. B. Allergien, entzündliche Erkrankungen), muss durch das Ausschliessen in Frage kommender Differentialdiagnosen geklärt werden.

Diagnoseschema mit vier Arten von Mastzellaktivierung: primäre, sekundäre, idiopathische und umweltbedingte.
Es kann unterschieden werden zwischen primärer, sekundärer, idiopathischer und umweltbedingter Mastzellaktivierung:
- Primär: Formen von Mastozytose mit bekannter körperlicher Ursache.
- Sekundär: andere Erkrankungen mit Mastzellaktivierung, z.B. Allergien, entzündliche Erkrankungen, reaktive Mastzellhyperplasie. Ausführlicher ist die sekundäre MCA beschrieben auf der Seite Mastzellerkrankungen > systematische Unterteilung.
- Idiopathisch: unbekannte Ursache. Vermutlich ebenfalls zur Mastozytose zu zählen, obwohl die derzeit geltenden WHO-Diagnosekriterien nicht erfüllt werden.
- Umweltbedingt: Die Mastzellen eines jeden Menschen lassen sich aktivieren, wenn der Reiz stark genug ist. Das ist bloss eine Frage der Dosis. Die Aktivierung geschieht nicht auf Grund einer körperlichen Ursache, sondern auf Grund ungünstiger äusserer Einflüsse (z.B. Exposition gegenüber reizenden Chemikalien, extreme psychische Belastungen).
Diagnosekriterien für MCAS und Mastozytose
Vorgeschlagene Diagnosekriterien für das Mastzellaktivierungssyndrom (MCAS) und die offiziellen WHO-Kriterien zur Diagnose von systemischer Mastozytose (SM), in Anlehnung an Molderings et. al. [2011, Tab. 2]:
| Kriterien für das Mastzellaktivierungssyndrom (MCAS) | WHO-Kriterien für systemische Mastozytose (SM) |
|---|---|
| Die Diagnose MCAS wird gestellt, wenn beide Hauptkriterien oder das zweite Hauptkriterium und mindestens ein Nebenkriterium erfüllt sind. | Die Diagnose SM wird gestellt, wenn das Hauptkriterium und mindestens ein Nebenkriterium oder mindestens drei Nebenkriterien erfüllt sind. |
| Hauptkriterien | Hauptkriterium |
| Dichte Infiltrate von Mastzellen, verstreut oder in Nestern, in Biopsien aus Knochenmark oder anderen inneren Organen/Geweben (nicht aus der Haut), angefärbt mit CD117, Tryptase und CD25. | Mehrere dichte Mastzellinfiltrate (> 15 Mastzellen pro Ansammlung) in Biopsien aus Knochenmark oder anderen inneren Organen/Geweben (nicht aus der Haut), angefärbt mit CD117, Tryptase und CD25. |
| Vorhandene Symptomatik lässt eine erhöhte Mastzellaktivität vermuten (Mastzellmediatorsyndrom) | |
| Nebenkriterien | Nebenkriterien |
| Mehr als 25% der Mastzellen in der Biopsie (Ausstrich oder Histologie) haben eine atypische Form (spindelförmig oder oval anstatt rund). | Mehr als 25% der Mastzellen in der Biopsie (Ausstrich oder Histologie) haben eine atypische Form (spindelförmig oder oval anstatt rund). |
| Mastzellen im Knochenmark exprimieren CD2 und/oder CD25 | Mastzellen im Knochenmark exprimieren CD2 und/oder CD25 |
| Nachweis von genetischen Veränderungen in Mastzellen aus Blut, Knochenmark oder inneren Organen, die bekanntermassen die Mastzellaktivität erhöhen | KIT D816V-Mutation in Mastzellen aus inneren Organen/Geweben |
| Nachweis einer krankhaft erhöhten Freisetzung eines Mastzellmediators (relativ zum Grundspiegel in der symptomarmen Phase) bei Bestimmung von Tryptase im Blut, N-Methylhistamin im Urin, Heparin im Blut, Chromogranin A im Blut, oder von anderen mastzellspezifischen Mediatoren (z.B. Leukotriene, Prostaglandin D2) | Totale Serumtryptase >20 ng/ml (nicht zutreffend bei gleichzeitiger Nichtmastzell-Bluterkrankung) |
Keine Ausschlusskriterien
Die WHO-Kriterien sind keine absoluten Diagnosekriterien, sondern ein vorläufiges Klassifikationssystem mit bestimmten Einschlusskriterien. Sie sind jedoch nicht ausreichend sensitiv und spezifisch. Werden die Kriterien nicht erfüllt, darf dies nicht dazu verleiten, eine Mastzellerkrankung auszuschliessen. [Homann et al. 2010b]
Vorgehen
Vorgehen als Patient
Sammeln Sie Ihre Unterlagen und Erinnerungen über Ihre bisherige Krankengeschichte und schreiben Sie sich alles, was in diesem Zusammenhang wichtig sein könnte, auf: Wann gab es welche Krankheiten, Symptome, Auslöser, Arztbesuche, Untersuchungen, Diagnosen, Therapien? Bringen Sie Ihre Unterlagen mit zur Arztkonsultation.
Soll der Patient schon vor dem Aufsuchen eines Arztes die Auslassdiät ausprobieren, um bereits mit einer konkreten Verdachtsdiagnose zum Arzt gehen zu können, oder ist es besser, als erstes mit all seinen unspezifischen Symptomen zum Arzt zu gehen, noch bevor man eine Idee hat, was es sein könnte? Diese Frage lässt sich nicht so eindeutig beantworten. Wenn man die Auslassdiät bereits ausprobiert hat und gut darauf angesprochen hat, kann man dem Arzt bereits die entscheidenden Hinweise geben, dass es sich um eine Mastzellerkrankung oder Histamin-Unverträglichkeit, oder um eine andere Nahrungsmittel-Unverträglichkeit oder -allergie (oder Kombinationen davon) handeln könnte. Der laboranalytische Nachweis von Mastzellmediatoren kann jedoch nur gelingen, wenn die Probenahme zu einem Zeitpunkt mit starken Symptomen erfolgt. Allerdings gelingt dieser Nachweis sowieso in den meisten Fällen nicht, siehe weiter unten. Sollte sich der Arzt für eine Darmspiegelung entscheiden, kann er evtl. keine Entzündungszeichen mehr sehen, nachdem diese unter der Diät bereits abgeklungen sind.
Was aber sicher nicht schaden kann, ist das Führen eines Ernährungs- und Symptomtagebuches schon vor dem Arztbesuch.
Vorgehen des Arztes
Es gibt bereits Konsensusdokumente, in denen sich mehrere auf Mastzellerkrankungen spezialisierte Mediziner auf Vorschläge geeinigt haben, wie man bei der Diagnose vorgehen sollte. Die Forschung steht hier aber noch am Anfang. Die Methoden und Meinungen befinden sich noch in einer recht jungen Entwicklungsphase. Literaturempfehlungen zur Diagnose finden Sie weiter unten auf dieser Seite.
Anamnese (Arzt-Patienten-Gespräch)
In einem ersten Gespräch wird der Arzt die Vorerkrankungen, den aktuellen Zustand und je nach dem auch Erkrankungen der näheren Verwandten (erbliche Vorbelastung) und die derzeitige Lebenssituation erfragen (berufliche Tätigkeit, Freizeitaktivitäten, besondere psychische Belastungen). Gleichzeitig kann auch bereits auf äusserlich sichtbare Anzeichen einer (sehr seltenen) Hautmastozytose geachtet werden.
Bei diesem komplexen, vielfältigen, schwer zu erfassenden Krankheitsbild lauern noch einige Schwierigkeiten, derer sich der Arzt bewusst sein sollte:
Es gibt kein einheitliches Beschwerdebild!

Das Beschwerdebild dieser Krankheit präsentiert sich von Fall zu Fall wieder ganz anders. Es ist wandelbar wie ein Chamäleon.
Wie bereits auf der Seite Symptome beschrieben, gibt es kein einheitliches Beschwerdebild, an welchem man eine systemische Mastzellaktivierungserkrankung erkennen könnte. Jeder Fall präsentiert sich wieder ganz anders. Es gibt aber eine enorm breite Palette möglicher Symptome (Mastzellmediatorsyndrom). In den meisten Fällen treten viele dieser Symptome auf. Nicht unbedingt alle gleichzeitig und gleich oft. Es gibt aber auch Fälle, wo nur eines oder wenige Symptome als störend empfunden werden. Z.B. "nur" immer wieder mal Migräne oder Durchfall.
Unvollständige Erfahrungsberichte

Der Arzt erfährt nur bruchstückhaft von den zahllosen Leiden seines Patienten, sieht nur die Spitze des Eisbergs.
Was dem Arzt bei der Anamnese ebenfalls bewusst sein muss: Der Arzt erfährt nur bruchstückhaft von den Leiden seines Patienten. Der Patient hat meist schon eine sehr lange Ärzteodyssee hinter sich, wo er gelernt hat, dass es nichts bringt oder meist sogar kontraproduktiv ist, wenn er versucht, seine mehrere Dutzend Symptome aufzuzählen (was ohnehin meist kaum gelingt in schwereren Fällen, wo Erschöpfung, Konzentrations- und Wortfindungsstörungen, beeinträchtigte Motorik des Sprechapparates, eingeschränktes Erinnerungsvermögen, Antriebslosigkeit und depressive Verstimmungen zu den Symptomen gehören). Die Reaktionen der zuvor bereits erfolglos konsultierten Ärzte haben den Patienten gelehrt, höchstens noch die zwei, drei wichtigsten Symptome zu erwähnen.
Der Betroffene ahnt meist auch gar nicht, dass seine völlig unterschiedlichen, nicht unbedingt zeitgleich auftretenden Symptome etwas miteinander zu tun haben, und beabsichtigt mit seinem Arztbesuch möglicherweise nur mal das eine Symptom anzugehen, das ihn gerade am meisten plagt, erwähnt vielleicht nur dasjenige, auf das der Arzt, den er aufsucht, spezialisiert ist.
Vielleicht hat der Patient auch mit den Jahren gelernt, diese Beschwerden einfach als eine nicht therapierbare Eigenheit seines Körpers zu akzeptieren, und hat sich längst damit abgefunden. Vielleicht denkt er gar nicht an die Möglichkeit, dass bestimmte Symptome mit anderen Symptomen in Zusammenhang stehen könnten. Möglicherweise kennt er sogar von Geburt an nur diesen Zustand und hat gar keine Vorstellung davon, wie es seinen gesunden Mitmenschen geht.
Der Arzt sollte daher davon ausgehen, dass ihm nur die Spitze des Eisbergs präsentiert wird. [Afrin 2014; Afrin et al. 2017; Erfahrungen von Mitgliedern]
Auslöser schwer identifizierbar
Dass der Arzt den Patienten fragt, welche Lebensmittel er nicht verträgt, kann durchaus manchmal wertvolle Hinweise liefern. Der Arzt sollte sich jedoch bewusst sein, dass die Betroffenen sehr oft die Auslöser nicht oder höchstens sehr unvollständig identifizieren können. Typischerweise konsumiert der noch undiagnostizierte und ahnungslose Betroffene mit jeder Mahlzeit mehrere unverträgliche Zutaten. Das erschwert das Erkennen einzelner Auslöser beträchtlich. Die Symptome kommen teils um mehrere Stunden zeitverzögert. Bis dann hat man längst wieder anderes gegessen und getrunken und verdächtigt womöglich die falschen Mahlzeiten als unverträglich. Wer vorwiegend mit chronisch-entzündlichen Symptomen reagiert, dem geht es permanent schlecht, egal was er gerade isst oder weglässt.
Wie wenn das noch nicht schwer genug wäre, gibt es noch die besonders tückischen Lebensmittel. Zitrusfrüchte beispielsweise enthalten sehr viel Vitamin C, welches sehr rasch ins Blut aufgenommen wird und dort den Histaminspiegel zunächst zu senken vermag. Das Hirn lernt daher: "Orangensaft tut mir gut". Die enthaltenen Liberatoren werden hingegen erst nach vielleicht vier bis sechs Stunden während der Darmpassage allmählich in den Körper aufgenommen und setzen dort etwa zwei Tage lang Histamin frei. Der Betroffene wird dennoch der Überzeugung sein, dass Zitrusfrüchte für ihn gesund sind, obwohl er davon krank wird.
Wird ein Betroffener nach der Verträglichkeit bestimmter Auslöser befragt, wird man aus oben genannten Gründen sehr oft falsche Antworten erhalten. Trotzdem sollte man den Patienten ernst nehmen, auch wenn seine Angaben nicht so recht ins Bild passen wollen und scheinbar nicht gut reproduzierbar sind. Seine Symptome sind dennoch in den allermeisten Fällen real und nicht eingebildet. Ignorieren darf man den Patienten lediglich in dem Sinne, dass eine MCAD nicht ausgeschlossen werden darf, wenn der Patient unverträgliche Lebensmittel als gut verträglich bezeichnet.
Fehlendes Systemdenken der Ärzte
Diese Fachspezialisten versuchen gerade, den Gegenstand in der Bildmitte zu identifizieren, machen dabei aber einen ziemlich blinden Eindruck. Der Elefant bleibt unerkannt. (Klicken zum Vergrössern.)
Ganz ähnlich wie in der oberen dieser beider Abbildungen lief es bisher ab, wenn Ärzte versuchten, einen MCAS-Patienten zu diagnostizieren: Jeder sah nur dasjenige Mastzellmediator-Symptom, auf das er spezialisiert war, oder nur diejenige Folgeerkrankung, die innerhalb seines Fachgebietes liegt, und hielt das für die eigentliche Krankheit. Das grosse Ganze, die allen Symptomen zu Grunde liegende Mastzellerkrankung, blieb unentdeckt und unbehandelt.
Unsere Vision: In Zukunft wird sich eine neue Generation von Ärzten vom Symptombekämpfungsdenken abwenden und stattdessen versuchen, diese Erkrankung als Ganzes zu erkennen und zu verstehen, um möglichst gezielt deren Ursache angehen zu können. (Klicken zum Vergrössern.)
Viele Diagnosen, ausbleibende Therapieerfolge
Sehr typisch ist auch, dass Betroffene bei früheren Arztbesuchen schon zahlreiche unterschiedliche oder ähnliche Diagnosen erhalten haben. Diese Diagnosen umschreiben jeweils lediglich einzelne mögliche Symptome, Ausprägungen oder Folgeerkrankungen der MCAD, ohne die wirkliche Ursache benennen zu können (z.B. "Reizdarmsyndrom", "nichtallergische Rhinitis", "Urtikaria", "Augenentzündung", "multiple Allergien", "chronisches Erschöpfungssyndrom", "Einschlaf- und Durchschlafstörungen", "Fibromyalgiesyndrom", "Psychosomatik", "Burnoutsyndrom", "schwaches Immunsystem").
Die auf solche Diagnosen ausgerichteten symptomatischen Therapien zeigen bei MCAD typischerweise nicht den erwarteten Erfolg oder führen sogar zu einer Verschlechterung. Dies nicht nur deshalb, weil bloss die Symptome anstatt möglichst gezielt die Ursache angegangen werden, sondern auch, weil Medikamente verschrieben wurden, deren Wirkstoffe oder Hilfsstoffe bei MCAD unverträglich sind.
Merke: Auch eine Flut von Diagnosen und Therapieversagen in der Vergangenheit können folglich für den Arzt wertvolle Hinweise sein, dass an eine MCAD gedacht werden muss.
Sehr häufige Erkrankung
Entgegen der bisherigen Lehrmeinung sind die Mastzellaktivierungserkrankungen gar nicht selten. Eine bisher übersehene Form, das MCAS, betrifft einen zweistelligen Prozentsatz der Bevölkerung! Siehe Seite Mastzellaktivierung > Häufigkeit, Prävalenz. Hinzu kommt noch, dass Betroffene wegen der Erkrankung möglicherweise überdurchschnittlich oft einen Arzt aufsuchen. Medizinische Fachpersonen sollten daher bei jedem Patienten in Betracht ziehen, dass mit hoher Wahrscheinlichkeit eine MCAD die eigentliche (wenn auch nicht offensichtliche) Ursache für die Arztkonsultation sein könnte (siehe Abbildung mit dem Elefanten!).
Meist mehrere Organsysteme betroffen
Entgegen der bisherigen Lehrmeinung ist die Mastozytose keine reine Hauterkrankung, sondern nebst der kutanen Mastozytose können auch alle anderen Organsysteme in unterschiedlicher Konstellation von der systemischen Mastozytose betroffen sein, sei es mit oder ohne Hautbeteiligung. Man sieht daher einem Patienten meist von aussen nichts an.
Differentialdiagnostik
Die Differentialdiagnostik (Abklärung anderer Erkrankungen, die ebenfalls für die beobachtete Symptomatik verantwortlich sein könnten) ist ein kompliziertes Detektivspiel, das wir hier nicht umfassend darstellen können. Das Vorgehen ist sehr vom individuellen Einzelfall abhängig und gehört in die Hände einer Fachperson. Ein paar Aspekte seien hier dennoch erwähnt:
Mastzellaktivierung kann auch durch andere Erkrankungen sekundär verursacht werden, ohne dass eine MCAD vorliegt. Siehe oben.
Die Wahrscheinlichkeit ist hoch, dass man nebst einer MCAD noch von weiteren Unverträglickeiten, Narungsmittelallergien oder Kreuzreaktionen, Autoimmunerkrankungen, Stoffwechselstörungen, ernährungsbedingte Vitamin- oder Nährstoffmangelzustände etc. betroffen sein könnte. Wenn die Symptome von mehreren körperlichen Ursachen ausgelöst werden, bringt es nur wenig, wenn man bloss eine dieser Erkrankungen therapiert. Für den bestmöglichen Therapieerfolg müssen alle Ursachen gefunden und therapiert werden.
Beispiele: Laktose-Intoleranz (Unverträglichkeit gegen Milchzucker), Fructose-Intoleranz (Unverträglichkeit gegen Fruchtzucker), Salicylat-Intoleranz (Unverträglichkeit gegen Salicylaten in Medikamenten und in sehr vielen pflanzlichen Nahrungsmitteln), Zöliakie / Sprue (Allergie gegen Gluten in Getreideprodukten), Gluten-Unverträglichkeit, Allergie gegen Milchprotein.
Indem das Blut auf bestimmte Antikörper getestet wird, kann das Vorliegen einer Allergie festgestellt werden. VORSICHT: Wenn die Beschwerden im Zusammenhang mit der Nahrungsaufnahme auftreten, muss an eine gastrointestinale Allergie gedacht werden. Solche den Darm betreffende Allergien können auch seronegativ verlaufen, d.h. im Blut sind keine IgE-Antikörper nachweisbar, obwohl eine Allergie vorliegt (Entopie, nur lokale IgE-Sensibilisierungen)! Solche lokalen Allergien im Darm können mit den üblichen Allergietests (Prick-Test, Bluttest) nicht immer gefunden werden. [Molderings et al. 2014; Lillestol et al. 2010; Raithel et al. 2012; Wikipedia: gastrointestinale Lavage]
Diagnostik
Die Diagnosestellung der MCAD wird zumindest in absehbarer Zukunft in erster Linie auf dem laborchemischen Nachweis von erhöhten Konzentrationen mastzellspezifischer Mediatoren oder deren Abbauprodukten (Metaboliten) in Blut und Urin basieren. Diese wie auch die anderen hier beschriebenen Methoden haben jedoch ihre Schwächen.
Mediatornachweis
Eines der Diagnosekriterien besteht im Versuch, einen der vielen freigesetzten Mastzellmediatoren oder deren Abbauprodukte nachzuweisen. In sehr vielen Fällen gelingt dies jedoch nicht. Dazu tragen die folgenden Gründe bei:
- Eine Mastzelle kann mehr als 200 verschiedene Mediatoren freisetzen. Die Freisetzung kann selektiv erfolgen, d.h. es werden nicht immer alle 200 Mediatoren ausgeschüttet und schon gar nicht im gleichen Mengenverhältnis. Je nach dem, durch welche körperliche Ursache die Mastzelle pathologisch verändert ist, in welchem Gewebe sie sich befindet und durch welchen chemischen, physikalischen oder psychischen Reiz sie aktiviert wird, werden von den einen Mediatoren mehr, von anderen weniger oder vielleicht gar nichts ausgeschüttet. Möglich ist sowohl die schockartige Degranulation der Mastzelle mit plötzlicher Freisetzung grosser Mengen, wie auch eine konstant andauernde Exocytose auf niedrigerem Niveau.
- Nicht nur Mastzellen, sondern auch ein paar wenige andere Zelltypen können Mediatoren wie Histamin freisetzen.
- Nur für ein paar wenige Mediatoren sind überhaupt routinemässige Tests kommerziell erhältlich (siehe Tabelle weiter unten). Für alle anderen existieren noch gar keine Nachweismethoden, oder höchstens im Rahmen eines Forschungsprojektes.
- Die Mediatoren werden im Gewebe in die Zellzwischenräume ausgeschüttet. Dort binden sie an die Rezeptoren der Zielzellen oder an andere Proteinstrukturen und sind daher nicht mobil. Zudem werden sie rasch wieder abgebaut. Sehr oft gelangen daher Mediatoren nach ihrer Freisetzung gar nicht in nachweisbarer Menge über das Lymphsystem bis in die Blutbahn.
- Timing: Die Entnahme der Proben muss zum richtigen Zeitpunkt, während dem Auftreten der Symptome oder kurz danach, erfolgen. Wenn man im Voraus einen Termin für die Blutabnahme erhält und dann gerade einen guten, beschwerdefreien Tag hat, werden wohl kaum erhöhte Werte nachgewiesen werden können. Man könnte aber mit seinem Hausarzt vorgängig vereinbaren, dass man beim Auftreten von Symptomen spontan in die Praxis kommen darf und dass dann Blut abgenommen und ins Labor gegeben werden soll, ohne dass man erschöpft und antriebslos noch lange erklären und argumentieren muss.
- Nicht alle Mediatoren sind uneingeschränkt mastzellspezifisch. Einige Mediatoren werden auch von anderen Zelltypen produziert, können durch andere Erkrankungen, durch Stoffwechselvorgänge oder über die Ernährung beeinflusst sein. Die Interpretation der Laborwerte sollte daher durch einen Spezialisten erfolgen, der sich mit diesen Einflussfaktoren auskennt.
- Jede Studie kommt wieder zu ganz anderen Resultaten zur Sensitivität eines Mediators (d.h. bei wie vielen Prozent der Betroffenen der Nachweis erhöhter Werte gelang, siehe Tabelle weiter unten). Diese Erfolgsraten sind zudem nicht gerade berauschend hoch. Die Aussagekraft ist daher erstens begrenzt und zweitens noch nicht ausreichend geklärt.
- Die Proben müssen je nach Mediator und Methode ausreichend schnell und unter geeigneten Bedingungen in ein darauf spezialisiertes Labor gelangen und analysiert werden.
- Je nach Methode sind die Werte eines Labors nicht mit denjenigen eines anderen Labors vergleichbar. Dann darf für die Einschätzung, ob dies ein krankhaft erhöhter Wert ist oder nicht, nur der Referenzbereich desjenigen Labors berücksichtigt werden, welches die Probe analysiert hat. Der Vergleich mit Werten aus der Literatur oder von anderen Labors ist nicht zulässig.
- Was für Auswirkungen eine bestimmte Menge eines freigesetzten Mediators hat, hängt davon ab, in welchem Organ oder Gewebe er freigesetzt wird. Die Konzentration im Blut oder Urin sagt darüber nichts aus.
- Weitere unbekannte oder nicht einschätzbare Einflussgrössen.
Daraus ergeben sich zwei Schlussfolgerungen:
- Nur ein positiver Befund kann aussagekräftig sein. Ein negativer Befund kann das Vorliegen einer MCAD nicht ausschliessen.
- Die nachgewiesenen Konzentrationen lassen keine Rückschlüsse auf den Schweregrad der Erkrankung bzw. auf die Intensität der Symptome zu [Broesby-Olsen S et al. 2013]. Es muss überhaupt nicht sein, dass jemand ohne erhöhte Messwerte ein Simulant oder besonders wehleidig ist, wenn er eine gleich starke Symptomatik schildert wie jemand mit sehr hohen Messwerten. Umgekehrt soll es auch Personen geben, die trotz schwerwiegendem Befund kaum Symptome haben.
Bestimmbare Mastzellmediatoren
Zur Diagnosesicherung und Subklassifizierung einer MCAD wird derzeit in der Literatur empfohlen, im Verdachtsfall die Gehalte der Mastzellbotenstoffe Tryptase und Heparin im Blut sowie Methylhistamin im Sammelurin zu bestimmen. In Zukunft seien auch weitere Biomarker (z.B. Leukotriene, Prostaglandin D2) in die Untersuchungen mit einzubeziehen, sobald diese in der kommerziellen Routinediagnostik bestimmbar werden sollten. [Molderings 2014]
| Mediator | Prozentsatz der Betroffenen, bei denen der Nachweis erhöhter Werte gelang (je nach Studie) | Mastzellspezifität |
|---|---|---|
| Tryptase im Blutserum > 20 ng/ml | MCAS: 0-33% SM: 77-85% | Mastzellspezifisch, falls keine bösartigen Bluterkrankungen und Nierenkrankheiten im Endstadium bestehen. 10% Fehlerrate wegen Wechselwirkung mit Rheumafaktor |
| N-Methylhistamin im 24 h-Sammelurin | MCAS: 0-95% SM: 50-81% | Histamin wird auch aus basophilen Granulozyten freigesetzt. Zudem durch Histamin- und Proteingehalt der Nahrung beeinflusst. |
| Serotonin im Blut | MCAS: 0% SM: 0-34% | Kommt vor allem in enterochromaffinen Zellen, serotonergen Neuronen und Blutplättchen vor, in kleinerem Masse auch in Mastzellen. |
| Leukotriene im Urin | SM: 44-50% | Wird von vielen Zelltypen produziert, nicht nur von Mastzellen. |
| Prostaglandin D2 und seine Abbauprodukte im Urin | MCAS: 75-86% SM: 62-100% | |
Da die Bestimmung mehrerer Mediatoren oder deren Abbauprodukte im Blut und im 24 h-Sammelurin für den Patienten unangenehm und zeitaufwändig und für das Gesundheitssystem teuer ist, stellt sich angesichts der oben genannten Unsicherheiten und Einschränkungen die Frage, in welchen Fällen dies überhaupt sinnvoll ist. Als einfachste Möglichkeit schlagen wir vor, in leichteren, einfacheren Fällen den Mediatornachweis als Kriterium fallen zu lassen und die Verdachtsdiagnose anhand der zwei folgenden Kriterien der Tabelle zu stützen:
- Therapiebedürftige Symptome vorhanden
- Symptome bessern sich unter mastzellspezifischer Therapie (Medikation oder Auslassdiät)
Magenspiegelung, Darmspiegelung, Gewebeproben
Da fast immer auch der Verdauungstrakt von Problemen betroffen ist, wird für eine genauere Abklärung eine Magenspiegelung (Gastroskopie) und eine Darmspiegelung (Koloskopie) empfohlen. Diese Untersuchungen dienen auch der Entnahme von Gewebeproben (Biopsien). Diese Biopsien der Magen- und Darmschleimhaut werden vor allem an Stellen entnommen, die mit der eingeführten Minikamera einen Befund (z.B. Entzündungszeichen) erkennen lassen.
Von den Gewebeproben werden mikroskopische Präparate angefertigt und untersucht:
- Mit bestimmten Färbetechniken (z.B. immunhistochemisch mit CD117-, Tryptase- und CD25-Antikörpern) werden die Präparate eingefärbt, um die aktivierten Mastzellen sichtbar zu machen.
- Auffällige Anordnungen und Formen (Morphologie) der Mastzellen sind Hinweise auf Mutationen in Mastzellen. Eine unauffällige Morphologie schliesst jedoch aktivierende Mutationen keinesfalls aus. Nur von ganz bestimmten Mutationen in Exon 17 der Tyrosinkinase KIT weiss man, dass sie zu morphologischen Auffälligkeiten (spindelförmig, Zusammenlagerung in Zellnestern) führen können, dass CD25 immunhistochemisch nachweisbar ist, und dass biochemisch ein erhöhter Tryptasespiegel (> 20 ng/ml) im Blut messbar ist. [Molderings et al. 2014; Haenisch et al. 2012]
- Die Mastzelldichte wird ausgezählt: "Eine Dichte von mehr als 19 Mastzellen pro Gesichtsfeld (bei 40× Vergrößerung) wird in Magen- und Darmbiopsien als pathologisch angesehen." [Mehrere Quellen, aufgeführt in Molderings et al. 2014]
Nur positive Biopsiebefunde sind aussagekräftig. Negative Befunde dürfen nicht als Ausschlusskriterium gesehen werden.
Mutationsanalyse
Mastzellenüberaktivitätsstörungen werden durch Mutationen in bestimmten Genen verursacht, die zu Daueraktivierung der Mastzellen führen. Es liegt daher nahe, mittels Gentests oder Mutationsanalysen nach abweichenden Genvarianten zu suchen. Die grosse Schwierigkeit dabei ist jedoch:
- Nach heutigem Kenntnisstand können wahrscheinlich viele verschiedene Kombinationen von Genvarianten, die mehrere verschiedene Gene betreffen, zu einer Mastzellaktivierung führen.
- Vermutlich sind aber die meisten dieser möglichen Gene bzw. Mutationen noch unbekannt. Die bereits bekannten Genmutationen findet man zwar bei SM oft, bei MCAD hingegen nur sehr selten. [Molderings et al. 2014]
- Meistens handelt es sich nicht um eine erbliche somatische Mutation (d.h. sämtliche Körperzellen tragen die Mutation), sondern um eine klonale Mutation (nur eine einzige Zelle mutiert und bringt durch Teilung weitere mutierte Zellen hervor, während alle anderen Körperzellen nicht betroffen sind). Deshalb kann man nicht einen herkömmlichen Gentest mit beliebigem Zellmaterial (Blutprobe, Mundschleimhautabstrich) durchführen. Stattdessen braucht man eine Gewebeprobe, welche Mastzellen enthält (gewonnen z.B. aus dem Knochenmark oder bei einer Darmspiegelung). Weil nur ein winziger Prozentsatz der Zellen betroffen ist, werden die Mastzellen zuvor meist separiert und aufkonzentriert, oder das aus der Gewebeprobe isolierte Mastzellen-Erbgut wird mittels PCR-Methode (polymerase chain reaction) vervielfältigt und untersucht. Das ist aufwändiger als ein gewöhnlicher Gentest.
Die einzige routinemässig verfügbare Mutationsanalyse ist gegenwärtig die spezifische PCR-Untersuchung von Mastzellen aus Biopsien auf das Vorliegen der KITD816V-Mutation. Der Nachweis der Mutation KIT D816V ist ein nach WHO zu bestimmendes Nebenkriterium für die Diagnose. Auf weitere Mutationen zu testen, wäre natürlich ebenfalls wünschbar, aber derzeit nicht möglich bzw. nicht erschwinglich. In Zukunft wird man vielleicht bei Verdachtsfällen irgendwann sämtliche an der Steuerung der Mastzellen beteiligten Gene sequenzieren oder eine umfassende Mutationsanalyse durchführen können.
- Wird per Mutationsanalyse in Exon 17 von KIT die Mutation D816V (oder eine andere) gefunden, bezeichnet man die MCAD als klonal. Das bedeutet so viel, wie dass die MCAD durch eine bekannte Mutation in einer einzigen Zelle hervorgerufen wurde.
- Findet man keine Mutation in Exon 17 von KIT, sollte man am ehesten von "nicht-identifizierter" Klonalität sprechen. Die heute noch beschränkten Untersuchungsmöglichkeiten lassen keine Aussage zu, ob eine andere, unbekannte Mutation vorliegt (ebenfalls klonal), oder ob es sich um ein nicht mutationsbedingtes (nicht-klonales) Phänomen handelt. Die Bezeichnung "nicht-klonal" wäre daher nicht angebracht.
Knochenmarkbiopsie
Mastzellen werden im Knochenmark aus Vorläuferzellen gebildet. Daher ist eine Gewebeprobe aus dem Knochenmark, normalerweise aus dem Beckenknochen (Beckenkammtrepanat, > 1,5 cm lang) eine gute Diagnosemöglichkeit und kann als Diagnosekriterium der systemischen Mastozytose gemäss WHO mit verwendet werden.
Zusätzlich dient die Knochenmarkbiopsie auch dazu, rechtzeitig auf eine eventuell bestehende hämatologische Zusatzerkrankung (Erkrankung von Blutzellen) aufmerksam zu werden. Bei Vorliegen einer Mutation in Exon 17 der Tyrosinkinase KIT beträgt das Risiko 30 %, dass die mutierten Vorläuferzellen / Stammzellen im Knochenmark auch andere Typen von Blutzellen produzieren, die ebenfalls diese Mutation tragen. Daraus könnte (selten) eine Leukämie entstehen.
Des weiteren ist dies die einzige Methode, mit der eine eventuelle Schädigung des Knochenmarks durch übermässige Einwanderung von Mastzellen festgestellt werden könnte.
Details zur Entnahme und den notwendigen Vorsichtsmassnahmen: [Valent et al. 2007]
Diese Untersuchungsmethode stellt für den Patienten einen grösseren unangenehmen Eingriff dar. Deshalb sollten zuerst die anderen Diagnosekriterien abgeklärt werden, und nur wenn diese einen Verdacht auf systemische Mastozytose liefern (Tryptasespiegel basal > 20 ng/ml; morphologisch auffällige Mastzellen in den Biopsien aus dem Gastrointestinaltrakt), sollte eine Biopsie des Beckenknochenmarks vorgenommen werden. Bei Patienten mit MCAS findet man hingegen nur selten Mastzellinfiltrate im Knochenmark, so dass bei diesen eine Biopsie nur in Ausnahmefällen angebracht ist. [Molderings 2014].
Ungefähr in jedem sechsten Fall gelingt es bei der Entnahme der Gewebeprobe nicht auf Anhieb, ein Nest mit mutierten Mastzellen zu treffen, so dass die Diagnose falsch negativ ist. Auch bei dieser Methode gilt: Nur ein positiver Befund ist aussagekräftig. Ein negativer Befund darf nicht aus Ausschlusskriterium gewertet werden.
Versuchsweise Durchführung der Therapie
Der Evidenzgrad der oben aufgeführten Diagnosemethoden ist gering. Sie liefern nur in einem kleinen Teil der Fälle ein positives Testergebnis. Die meisten MCAD-Betroffenen würden durch die Maschen fallen und keine Diagnose erhalten (falsch negatives Resultat). Nicht nur die positiv getesteten, sondern speziell auch die negativ getesteten, sollen deshalb einen weiteren Diagnoseschritt durchlaufen: Das versuchsweise (probatorische) Durchführen einer auf Mastzellen ausgerichteten Therapie während einer begrenzten Zeitdauer.
Die Therapie besteht aus:
- Meiden aller Auslöser, insbesondere Eliminationsdiät
- Medikation
Detaillierter wird die Therapie beschrieben auf der Seite Therapie und ihren zahlreichen Unterseiten, die auch Hilfsmittel anbieten (z.B. Kochbuch).
Für Ärzte mag es vielleicht ungewohnt und gewöhnungsbedürftig sein, eine Therapie zu beginnen, bevor eine hieb- und stichfeste Diagnose vorliegt. Mangels besserer Alternativen ist dies jedoch bei einem vermuteten Mastzellmediatorsyndrom das Sinnvollste und Zielführendste, was man machen kann. Es kostet auch weniger, als alle möglichen Tests zu machen, ist wohl meist auch weniger unangenehm, und man kriegt gleich noch die Besserung des Befindens ohne Aufpreis mit dazu, falls man mit dem Verdacht richtig liegt. Diese zeitlich begrenzte versuchsweise Therapie ist die einzige Möglichkeit, um den durch die Maschen der heute noch unvollständigen Diagnostik fallenden Betroffenen dennoch die Hilfe zukommen zu lassen, die sie benötigen. Mastzellmediatorsymptome können sehr unangenehm schmerzhaft sein und teils schon auf rein biochemische Weise depressive Verstimmungen hervorrufen. Der Patient sollte keinesfalls mit qualvollen therapiebedürftigen Symptomen alleine gelassen werden, bloss weil die Möglichkeiten der Diagnostik noch nicht weit genug gediehen sind. Von der bekannten und funktionierenden Therapie sollte dennoch Gebrauch gemacht werden.
Angesichts der begrenzten labordiagnostischen Möglichkeiten könnte man sogar darüber nachdenken, ob nicht in leichteren, unkomplizierteren Fällen, wo die Anamnese recht klar auf ein Mastzellgeschehen hindeutet, die Labordiagnostik auch übersprungen werden könnte, um gleich mit der versuchsweisen Durchführung der Therapie zu beginnen. Spricht der Patient gut auf die Therapie an, würde dies die Verdachtsdiagnose indirekt stützen. Ein möglicher Nachteil könnte sein, dass man so nicht zwischen dem MCAS und einem Anfangsstadium der selten vorkommenden systemischen Mastozytose unterscheiden könnte. Die Therapie dieser schwerer verlaufenden Unterklasse der MCAD wäre jedoch die selbe wie beim MCAS, weshalb dem Patienten daraus kein Schaden erwachsen würde.
Leidet der Patient unter Durchfällen und spricht auf die Medikamente nicht in den ersten Tagen an, so funktioniert womöglich die Aufnahme der Wirkstoffe über den Darm nicht. Dann kann versucht werden, eine geeignete Kombination von Präparaten in der Anfangsphase zuerst intravenös zu verabreichen, um den Verdauungstrakt zu umgehen. Sobald sich die Verdauungsbeschwerden gebessert haben, kann auf die übliche Medikation umgestellt werden.
Empfohlene Fachliteratur zur Diagnose der MCAD
| Fachliteratur zur Diagnose der MCAD | |
|---|---|
| Afrin et al. 2015 | Afrin LB, Pöhlau D, Raithel M, Haenisch B, Dumoulin FL, Homann J, Mauer UM, Harzer S, Molderings GJ.: "Mast Cell Activation Disease: An Underappreciated Cause of Neurologic and Psychiatric Symptoms and Diseases." Brain Behav Immun. 2015 Jul 7. pii: S0889-1591(15)00236-6. doi: 10.1016/j.bbi.2015.07.002. https://pubmed.ncbi.nlm.nih.gov/26162709 (Fokus auf neurologische und psychiatrische Symptome und Folgeerkrankungen der MCAD. "We describe MCAD's pathogenesis, presentation (focusing on [central and/or peripheral neurologic and/or psychiatric symptoms] (NPS)), and therapy, especially vis-à-vis neuropsychotropes. Since MCAD patients often present NPS, neurologists and psychiatrists have the opportunity, in recognizing the diagnostic possibility of MCAD, to short-circuit the often decades-long delay in establishing the correct diagnosis required to identify optimal therapy.") |
| Molderings et al. 2014 | Molderings GJ, Homann J, Brettner S, Raithel M, Frieling T: "Systemische Mastzellaktivierungserkrankung: Ein praxisorientierter Leitfaden zu Diagnostik und Therapie" [Mast cell activation disease: a concise practical guide for diagnostic workup and therapeutic options]. Dtsch Med Wochenschr. 2014 Jul;139(30):1523-34; quiz 1535-8. doi: 10.1055/s-0034-1370055. Epub 2014 May 6. https://pubmed.ncbi.nlm.nih.gov/24801454 Sehr guter und aktueller Übersichtsartikel. |
| Valent et al. 2012 | Valent P, Akin C, Arock M, Brockow K, Butterfield JH, Carter MC, Castells M, Escribano L, Hartmann K, Lieberman P, Nedoszytko B, Orfao A, Schwartz LB, Sotlar K, Sperr WR, Triggiani M, Valenta R, Horny HP, Metcalfe DD.: "Definitions, criteria and global classification of mast cell disorders with special reference to mast cell activation syndromes: a consensus proposal". Int Arch Allergy Immunol. 2012;157(3):215-25. Epub 2011 Oct 27. http://www.ncbi.nlm.nih.gov/pubmed/22041891 FREI ZUGÄNGLICHER Übersichtsartikel, aber nicht der aktuellste. (Propose a global unifying classification of all MC disorders and pathologic MC reactions. This classification includes three types of 'MCA syndromes' (MCASs), namely primary MCAS, secondary MCAS and idiopathic MCAS. MCA is now defined by robust and generally applicable criteria, including (1) typical clinical symptoms, (2) a substantial transient increase in serum total tryptase level or an increase in other MC-derived mediators, such as histamine or prostaglandin D(2), or their urinary metabolites, and (3) a response of clinical symptoms to agents that attenuate the production or activities of MC mediators.) |
| Molderings et al. 2011 | Molderings GJ, Brettner S, Homann J, Afrin LB.: "Mast cell activation disease: a concise practical guide for diagnostic workup and therapeutic options". J Hematol Oncol. 2011 Mar 22;4:10. http://www.ncbi.nlm.nih.gov/pubmed/21418662 FREI ZUGÄNGLICHER Übersichtsartikel, aber nicht der aktuellste. |
| Hamilton et al. 2011 | Hamilton MJ, Hornick JL, Akin C, Castells MC, Greenberger NJ.: "Mast cell activation syndrome: a newly recognized disorder with systemic clinical manifestations." J Allergy Clin Immunol. 2011 Jul;128(1):147-152.e2. doi: 10.1016/j.jaci.2011.04.037. Epub 2011 May 28. https://pubmed.ncbi.nlm.nih.gov/21621255 |
| Homann et al. 2010 | Homann J, Kolck UW, Ehnes A, Frieling T, Raithel M, Molderings GJ.: "Die systemische Mastozytose - Standortbestimmung einer internistischen Erkrankung [Systemic mastocytosis - definition of an internal disease]". Med Klin (Munich). 2010 Aug;105(8):544-53. Epub 2010 Sep 8. http://www.ncbi.nlm.nih.gov/pubmed/20824412 |
Typische Reaktionen von Ärzten
Der Wissensstand betreffend MCAD in der Ärzteschaft ist auch heute noch erschreckend tief. Zwar haben wir grosses Verständnis dafür, dass bei solchen diffusen Krankheitsbildern die Diagnose und die Abgrenzung von anderen Erkrankungen nicht einfach sind und zu einem langwierigen Detektivspiel ausarten können. Allerdings haben MCAD-Patienten bis heute noch kaum Chancen, die richtige ärztliche Hilfe zu erhalten, sondern stossen mehrheitlich nur auf Ratlosigkeit und Unverständnis, wie die unten stehenden (echten, nicht von uns erfundenen) haarsträubenden Zitate zeigen. Dies obwohl man trotz verbleibender Unsicherheiten seit Jahren genug wüsste, um den Betroffenen helfen zu können. Wir bitten die Berufsverbände der Ärzte, diesen Missstand in ihrem eigenen Interesse baldmöglichst zu beheben, damit sich ihr Berufsstand nicht länger der Lächerlichkeit preisgibt, sondern zu dieser sehr häufigen und bedeutenden Krankheitsursache fachlich auf dem Stand des Wissens ist. Sprüche wie diese möchten wir Betroffenen uns jedenfalls bitte nicht mehr anhören müssen:
- Der Hausarzt, nachdem er beim immerzu erschöpften Patienten wenigstens einen leichten Eisenmangel diagnostizieren konnte: "Nein nein, das ist nichts und das geht dann schon wieder vorbei. Nehmen Sie das hier!" Drückt dem Patienten ein Röhrchen Multivitamintabletten in die Hand und schiebt ihn mit sanftem Druck auf den Rücken zur Tür hinaus. "Der Nächste bitte!"
- Der Hausarzt, nachdem die Allgemeinuntersuchung keinen Befund liefert: "Da kann man nichts machen. Das ist psychosomatisch."
- Der Hausarzt auf die wiederholte Bitte des Patienten, wenigstens endlich einmal die Ursache seiner ständigen Durchfälle abzuklären: "Na gut, dann testen wir halt mal auf Parasiten." Und nachdem in der Stuhlprobe keine Parasiten nachweisbar waren: "Sehen Sie: Es ist nichts. Sie haben nichts."
- Der Arzt tadelt die Patientin, die mit dem Verdacht auf Histamin-Unverträglichkeit zu ihm kam: "Unsinn! Histamin ist ein lebensnotwendiger körpereigener Stoff, folglich ist es gar nicht möglich, dass man darauf eine Unverträglichkeit entwickeln kann."
(Anmerkung der Redaktion: Erstens kann der Körper sehr wohl auf körpereigene Stoffe reagieren (Beispiel Autoimmunerkrankungen). Zweitens hat der Arzt noch nicht verstanden, dass der Mechanismus hier ein ganz anderer ist: Ein MCAD-Betroffener hat auf Grund seiner Erkrankung das Problem, dass Histamin aus der Nahrung in den Körper gelangen und dort die Histaminrezeptoren der aktivierten Mastzellen stimulieren und dadurch zusätzliches körpereigenes Histamin freisetzen kann. Zusätzlich können Liberatoren Mastzellmediatoren freisetzen. Das Körpergewebe des Betroffenen wird folglich mit viel grösseren Histaminmengen konfrontiert als das eines Gesunden, was unweigerlich zu Symptomen führen muss. Würde man dieselbe Menge einem Gesunden injizieren, würde er wohl ebenso reagieren.) - Die Spezialärztin im Beisein der Chefärztin, nach Auswertung umfangreicher tausendfränkiger Untersuchungen: "Also, wir nehmen Ihre Beschwerden natürlich ernst, aber gehen Sie doch mal zum Psychiater, wenn Sie sich einbilden, Ihnen fehle etwas!"
- Die Hausärztin auf die vom Patienten geäusserte Vermutung, dass es sich um eine Unverträglichkeit auf Histamin handeln könnte: "Nein, das können Sie gar nicht haben. Das ist nämlich selten."
- Der Hals-Nasen-Ohrenarzt zur Patientin: "Ja, Sie haben eine ständig laufende Nase und die Nasenmuscheln sind auch geschwollen. Das sehe ich." (Kurzes Aufatmen - der Arzt findet etwas!) "Da würde ich Ihnen eine OP empfehlen, eine Nasenmuschelverkleinerung. Das ist Routine heutzutage."
- Der Arzt zur Patientin, die von ständigen Durchfällen geschwächt und abgemagert ist: "Frau M., Sie sind halt ein Sensibelchen. Und schauen Sie sich mal an, Sie sind ja viel zu dünn. Da braucht man sich nicht zu wundern, wenn es Ihnen nicht gut geht. Essen Sie doch mal etwas Anständiges!"
- Nachdem der Patient mehrere Minuten lang über seine Symptome und Beobachtungen berichtet hatte, fragte der Arzt: "Hmm... haben Sie Beschwerden beim Wasserlassen?" - Patient: "Nein, aber was hat das mit meinem Schwindel zu tun?" - Arzt: "Nun... Harnwegsinfektionen kann man heutzutage sehr gut behandeln".
- Die Rheumatologin, nachdem der Patient ihr zwei Histaminliberatoren genannt hatte, die Schmerzen auslösen: "Nein, Sie können nicht auf diese Lebensmittel reagieren. Sie sollten sich nicht mit dem Essen befassen und sich bei der Wahl der Lebensmittel nicht einschränken. Sonst müssen wir Sie zur Abklärung zum Psychologen schicken."
- Der über Histaminose noch nicht informierte Hausarzt, nachdem der Patient diesem zur effizienteren Abwicklung schon vor der Erstkonsultation eine kurze schriftliche Zusammenfassung hierzu gegeben hatte: "Wo kämen wir da hin, wenn ich für jede Diagnose zuerst eine halbe Dissertation lesen müsste! Nennen Sie mir Ihr Symptom und ich verschreibe Ihnen ein Medikament gegen dieses Symptom! So funktioniert Medizin!!!"
(Anmerkung der Redaktion: Genau so funktioniert es eben nicht! Genau diese kurzsichtige Denkweise der Ärzte ist der Grund für die typischerweise jahrzehntelangen Odysseen der Betroffenen. Jahrzehntelang werden Unsummen für solche Schnellabfertigungen ausgegeben. Der Arzt verschreibt Kopfschmerztabletten gegen Kopfschmerzen, schleimlösende Medikamente gegen die laufende oder verstopfte Nase, Hustensirup gegen den Husten, Tabletten gegen Sodbrennen, Salben gegen Juckreiz und Hautausschlag, Schlaftabletten gegen Schlafstörungen, Ritalin gegen Konzentrationsstörungen, Antibiotika gegen Nebenhöhlenentzündungen, Mittel gegen Menstruationsbeschwerden oder Wasseransammlungen usw. Diese Mittel beheben aber nicht die eigentliche Ursache, sondern enthalten sogar meistens Wirkstoffe oder Zusatzstoffe, die bei Histaminose unverträglich sind und deshalb nicht helfen oder den Zustand noch verschlimmern können. Würde sich gleich von Anfang an ein Arzt die Zeit nehmen, um den Patienten gründlich abzuklären und zu recherchieren, bis die Ursache eingegrenzt wurde, würde dies wohl deutlich geringere Kosten verursachen. Erst recht wenn man auch noch die Produktivität am Arbeitsplatz, die Fehlerhäufigkeit und Unfallgefahr durch Unkonzentriertheit und Schlafmangel sowie den Gewinn an Lebensqualität dazu rechnet. So werden möglicherweise genau die "effizientesten" Schnellabfertigungsärzte zum grössten kostentreibenden Faktor im Gesundheitswesen.)
Zusätzlich zu ihren ohnehin schon grossen körperlichen Qualen müssen Betroffene solche Reaktionen typischerweise während Jahren oder Jahrzehnten über sich ergehen lassen, während sie Hilfe suchend von Arzt zu Arzt wechseln und unnötigerweise hohe Gesundheitskosten verursachen. So wäre es nicht verwunderich, wenn ein Betroffener schlussendlich tatsächlich psychologische Betreuung nötig hätte, um die unterlassene Hilfeleistung und die verletzenden Reaktionen der Ärzte verarbeiten zu können.
Liegt auch Ihnen noch so ein Ärztespruch in den Ohren, den Sie gerne loswerden möchten? Wir nehmen ihn gerne hier auf.
Geführter Rundgang: Weiter zur Seite
Therapie
Quellenangaben
Tipp: Der "zurück"-Button Ihres Browsers bringt Sie zur vorherigen Stelle zurück.
| A | Zurück zur vorherigen Stelle |
|---|---|
| Afrin et al. 2017 | Afrin LB, Self S, Menk J, Lazarchick J: "Characterization of Mast Cell Activation Syndrome" The American journal of the medical sciences. 2017;353(3):207-215. doi:10.1016/j.amjms.2016.12.013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5341697/ (Eine Beschreibung des Krankheitsbilds des systemischen Mastzellaktivierungssyndroms (MCAS)) |
| Afrin 2014 | Lawrence B. Afrin: "The Bulk of the Iceberg revealed: Mast Cell Activation Syndrome". Gastvortrag vom 6. August 2014 an der University of Cape Town, Südafrika, ca. ab Minute 0:28:00 des Videos. Nicht mehr abrufbar: http://meeting.uct.ac.za/p4j213xndbs/?launcher=false&fcsContent=true&pbMode=normal |
| Akin et al. 2010 | Akin C, Valent P, Metcalfe DD: "Mast cell activation syndrome: Proposed diagnostic criteria". J Allergy Clin Immunol. 2010 Dec;126(6):1099-104.e4. Epub 2010 Oct 28. http://www.ncbi.nlm.nih.gov/pubmed/21035176 |
| B | Zurück zur vorherigen Stelle |
| Brockow 2013 | Prof. Dr. K. Brockow: "Mastzellaktivierungssyndrome". Der Hautarzt, February 2013, Volume 64, Issue 2, pp 102-106. https://link.springer.com/article/10.1007/s00105-012-2452-6 |
| Brockow and Ring 2011 | Brockow K, Ring J.: "Update on diagnosis and treatment of mastocytosis". Curr Allergy Asthma Rep. 2011 Aug;11(4):292-9. http://www.ncbi.nlm.nih.gov/pubmed/21523372 |
| Broesby-Olsen et al. 2013 | Broesby-Olsen S1, Kristensen T, Vestergaard H, Brixen K, Møller MB, Bindslev-Jensen C: "KIT D816V mutation burden does not correlate to clinical manifestations of indolent systemic mastocytosis.". J Allergy Clin Immunol. 2013 Sep;132(3):723-8. doi: 10.1016/j.jaci.2013.02.019. Epub 2013 Apr 12. https://pubmed.ncbi.nlm.nih.gov/23587333 Die Mediatorkonzentrationen im Blut korrelieren nicht mit der Intensität der Symptome. |
| F | Zurück zur vorherigen Stelle |
| Frieri , Patel and Celestin 2013 | Frieri M, Patel R, Celestin J: "Mast cell activation syndrome: a review." Curr Allergy Asthma Rep. 2013 Feb;13(1):27-32. doi: 10.1007/s11882-012-0322-z. https://www.ncbi.nlm.nih.gov/pubmed/23179866 |
| H | Zurück zur vorherigen Stelle |
| Haenisch et al. 2012 | Haenisch B1, Nöthen MM, Molderings GJ.: "Systemic mast cell activation disease: the role of molecular genetic alterations in pathogenesis, heritability and diagnostics." Immunology. 2012 Nov;137(3):197-205. doi: 10.1111/j.1365-2567.2012.03627.x. https://pubmed.ncbi.nlm.nih.gov/22957768 |
| Hamilton et al. 2011 | Hamilton MJ, Hornick JL, Akin C, Castells MC, Greenberger NJ.: "Mast cell activation syndrome: a newly recognized disorder with systemic clinical manifestations." J Allergy Clin Immunol. 2011 Jul;128(1):147-152.e2. doi: 10.1016/j.jaci.2011.04.037. Epub 2011 May 28. https://pubmed.ncbi.nlm.nih.gov/21621255 |
| Homann et al. 2010 | Homann J, Kolck UW, Ehnes A, Frieling T, Raithel M, Molderings GJ.: "Die systemische Mastozytose - Standortbestimmung einer internistischen Erkrankung [Systemic mastocytosis - definition of an internal disease]". Med Klin (Munich). 2010 Aug;105(8):544-53. Epub 2010 Sep 8. http://www.ncbi.nlm.nih.gov/pubmed/20824412 |
| J | Zurück zur vorherigen Stelle |
| Jarisch 2004 | Jarisch, Reinhart: "Histamin-Intoleranz, Histamin-Intoleranz und Seekrankheit", Thieme-Verlag, 2. Auflage, 2004. ISBN 3-13-105382-8 |
| K | Zurück zur vorherigen Stelle |
| Kofler et al. 2009 | H. Kofler, W. Aberer, M. Deibl, Th. Hawranek, G. Klein, N. Reider und N. Fellner: "Diaminoxidase keine diagnostische Hilfe bei Histaminintoleranz", Allergologie, vol. 32, no. 3, pp. 105–109, 2009. https://www.dustri.com/nc/de/deutschsprachige-zeitschriften/mag/allergologie/vol/jahrgang-32-3/issue/maumlrz-1.html (Nur Abstract kostenlos abrufbar) |
| Kofler et al. 2011 | Lukas Kofler, Hanno Ulmer, Heinz Kofler: "Histamine 50-Skin-Prick Test: A Tool to Diagnose Histamine Intolerance", ISRN AllergyVolume 2011 (2011), Article ID 353045, 5 pages. doi:10.5402/2011/353045. https://www.isrn.com/isrn/allergy/2011/353045/, abgerufen am 25.11.2011. |
| L | Zurück zur vorherigen Stelle |
| Lange et al. 2015 | Lange M, Lugowska-Umer H, Niedoszytko M, Wasag B, Limon J, Zawrocki A, Nedoszytko B, Sobjanek M, Plata-Nazar K, Nowicki R.: "Diagnosis of Mastocytosis in Children and Adults in Daily Clinical Practice." Acta Derm Venereol. 2015 Aug 13. doi: 10.2340/00015555-2210. https://pubmed.ncbi.nlm.nih.gov/26270728 Frei zugänglicher Artikel. "This comprehensive review presents currently defined variants of the disease and recommendations to facilitate diagnostic work-up in children and adults with suspected mastocytosis in daily clinical practice." |
| Lillestol et al. 2010 | Lillestøl K1, Helgeland L, Arslan Lied G, Florvaag E, Valeur J, Lind R, Berstad A.: "Indications for atopic bowel in patients with self-reported food hypersensitivity." Aliment Pharmacol Ther. 2010 May;31(10):1112-1122. doi: 10.1111/j.1365-2036.2010.04261.x. https://pubmed.ncbi.nlm.nih.gov/20163379 Seronegative gastrointestinale Nahrungsmittelallergien. |
| M | Zurück zur vorherigen Stelle |
| Maintz et al. 2006 | Maintz, Laura; Bieber, Thomas; Novak, Natalija: "Die verschiedenen Gesichter der Histaminintoleranz: Konsequenzen für die Praxis (Histamine Intolerance in Clinical Practice)", Deutsches Ärzteblatt 2006; 103(51-52). https://www.aerzteblatt.de/V4/archiv/artikel.asp?id=53958, abgerufen am 25.08.2009. |
| Molderings et al. 2014 | Molderings GJ, Homann J, Brettner S, Raithel M, Frieling T: "Systemische Mastzellaktivierungserkrankung: Ein praxisorientierter Leitfaden zu Diagnostik und Therapie" [Mast cell activation disease: a concise practical guide for diagnostic workup and therapeutic options]. Dtsch Med Wochenschr. 2014 Jul;139(30):1523-34; quiz 1535-8. doi: 10.1055/s-0034-1370055. Epub 2014 May 6. https://pubmed.ncbi.nlm.nih.gov/24801454 |
| Molderings et al. 2011 | Molderings GJ, Brettner S, Homann J, Afrin LB.: "Mast cell activation disease: a concise practical guide for diagnostic workup and therapeutic options". J Hematol Oncol. 2011 Mar 22;4:10. http://www.ncbi.nlm.nih.gov/pubmed/21418662 Frei zugänglicher Übersichtsartikel |
| R | Zurück zur vorherigen Stelle |
| Raithel et al. 2012 | Raithel, Martin; Hahn, Eckhart Georg; Baenkler, Hanns-Wolf: "Klinik und Diagnostik von Nahrungsmittelallergien: Gastrointestinal vermittelte Allergien Grad I bis IV." Dtsch Arztebl 2002; 99(12): A-780 / B-641 / C-599. https://www.aerzteblatt.de/archiv/30916/Klinik-und-Diagnostik-von-Nahrungsmittelallergien-Gastrointestinal-vermittelte-Allergien-Grad-I-bis-IV |
| Redaktion | Empfehlung des Redakteurs dieser Website oder des Autors dieser Seite, welche aus den Erfahrungen und Anschauungen von betroffenen Laien hervorgegangen ist und lediglich unseren aktuellen Stand des Unwissens widerspiegelt. |
| Reese et al. 2012 | Imke Reese, Barbara Ballmer-Weber, Kirsten Beyer, Stephan Erdmann, Thomas Fuchs, Jörg Kleinetebbe, Ludger Klimek, Ute Lepp, Margot Henzgen, Bodo Niggemann, Joachim Saloga, Christiane Schäfer, Thomas Werfel, Torsten Zuberbier, Margitta Worm: "Vorgehen bei Verdacht auf Unverträglichkeit gegenüber oral aufgenommenem Histamin. Leitlinie der Deutschen Gesellschaft für Allergologie und klinische Immunologie (DGAKI), der Gesellschaft für Pädiatrische Allergologie und Umweltmedizin (GPA) und des Ärzteverbandes Deutscher Allergologen (ÄDA)". AWMF 2012 https://dgaki.de/wp-content/uploads/2010/05/Leitlinie_Histaminunverträglichkeit2012.pdf (177 kb). https://www.awmf.org/uploads/tx_szleitlinien/061-030l_S1_Histaminunverträglichkeit_2012.pdf (177 kb). (Leitlinie zur Diagnose des oralen Histaminsyndroms. Konsensusdokument.) |
| V | Zurück zur vorherigen Stelle |
| Valent et al. 2012 | Valent P, Akin C, Arock M, Brockow K, Butterfield JH, Carter MC, Castells M, Escribano L, Hartmann K, Lieberman P, Nedoszytko B, Orfao A, Schwartz LB, Sotlar K, Sperr WR, Triggiani M, Valenta R, Horny HP, Metcalfe DD.: "Definitions, criteria and global classification of mast cell disorders with special reference to mast cell activation syndromes: a consensus proposal". Int Arch Allergy Immunol. 2012;157(3):215-25. Epub 2011 Oct 27. http://www.ncbi.nlm.nih.gov/pubmed/22041891 (Propose a global unifying classification of all MC disorders and pathologic MC reactions. This classification includes three types of 'MCA syndromes' (MCASs), namely primary MCAS, secondary MCAS and idiopathic MCAS. MCA is now defined by robust and generally applicable criteria, including (1) typical clinical symptoms, (2) a substantial transient increase in serum total tryptase level or an increase in other MC-derived mediators, such as histamine or prostaglandin D(2), or their urinary metabolites, and (3) a response of clinical symptoms to agents that attenuate the production or activities of MC mediators.) |
| Valent et al. 2007 | Valent P, Akin C, Escribano L, Födinger M, Hartmann K, Brockow K, Castells M, Sperr WR, Kluin-Nelemans HC, Hamdy NA, Lortholary O, Robyn J, van Doormaal J, Sotlar K, Hauswirth AW, Arock M, Hermine O, Hellmann A, Triggiani M, Niedoszytko M, Schwartz LB, Orfao A, Horny HP, Metcalfe DD.: "Standards and standardization in mastocytosis: consensus statements on diagnostics, treatment recommendations and response criteria." Eur J Clin Invest. 2007 Jun;37(6):435-53. https://pubmed.ncbi.nlm.nih.gov/17537151 Frei zugänglicher Übersichtsartikel |
| Vysniauskaite et al. 2015 | Vysniauskaite M, Hertfelder HJ, Oldenburg J, Dreßen P, Brettner S, Homann J, Molderings GJ: "Determination of plasma heparin level improves identification of systemic mast cell activation disease." PLoS One. 2015 Apr 24;10(4):e0124912. doi: 10.1371/journal.pone.0124912. eCollection 2015. https://pubmed.ncbi.nlm.nih.gov/25909362 Frei zugänglicher Artikel (Plasma heparin level appears more sensitive than the other mediators for detecting systemic MC activity in patients with MCAS. The simple, brief venous occlusion test appears to be a useful indicator of the presence of pathologically irritable MCs, at least in the obstructed compartment of the body.) |
| W | Zurück zur vorherigen Stelle |
| Wikipedia: gastrointestinale Lavage | Wikipedia: "Gastrointestinale Lavage" Wikipedia-Artikel, abgerufen am 29.6.2015. https://de.wikipedia.org/wiki/Gastrointestinale_Lavage Endoskopisch gesteuerte segmentale gastrointestinale Lavage, um lokale Allergien gegen Nahrungsmittelbestandteile zu bestimmen, deren Nachweis mit herkömmlichen Allergietests nicht immer gelingt. |
| Wöhrl et al. 2004 | Wöhrl S, Hemmer W, Focke M, Rappersberger K, Jarisch R.: "Histamine intolerance-like symptoms in healthy volunteers after oral provocation with liquid histamine.". Allergy Asthma Proc. 2004 Sep-Oct;25(5):305-11. Floridsdorf Allergy Center (FAZ), Vienna, Austria. http://www.ncbi.nlm.nih.gov/pubmed/15603203 (50% von zehn gesunden Frauen ohne Anzeichen von Nahrungsmittelunverträglichkeiten in der Vergangenheit reagierten in einer doppelblinden, placebokontrollierten Studie auf die Gabe von 75 mg Histamin in flüssiger Form mit Symptomen, während keine einzige Person auf das Placebo reagierte. Teilweise traten die Reaktionen zeitlich stark verzögert auf.) |
| Z | Zurück zur vorherigen Stelle |
| Zopf et al. 2009 | Zopf, Yurdagül; Baenkler, Hanns-Wolf; Silbermann, Andrea; Hahn, Eckhart G.;Raithel, Martin: "Differenzialdiagnose von Nahrungsmittelunverträglichkeiten / The Differential Diagnosis of Food Intolerance". Dtsch Arztebl Int 2009; 106(21): 359-69 |
![[Logo MCAD]](../pics/logo_mcas_160x160_bkg045552.png)

